De op wetenschappelijk bewijs gebaseerde geneeskunde kreeg een grote stimulans met de introductie van de evidence-based medicine (EBM). Nationale en internationale verschillen in behandelingen verdwijnen daardoor geleidelijk en goede en slechte behandelingen kunnen beter worden onderscheiden.
Inleiding
In de jaren zeventig van de vorige eeuw ontstond in de Verenigde Staten een beweging die streefde naar betere onderbouwing van het medisch handelen. Deze beweging werd met name gevormd en gesteund door epidemiologen, methodologen en statistici. Zij streefden naar een wetenschappelijke onderbouwing van het medisch handelen op basis van het beste wetenschappelijke bewijs, de zogenoemde evidence-based medicine,[1] waarin de Amerikaanse arts David Sackett een leidende figuur was.
Voorheen bestonden voor veel aandoeningen en klachten in de geneeskunde uiteenlopende behandelingen waarbij het persoonlijke oordeel van een gezaghebbende arts doorslaggevend was. Dit was bekend als de authority-based medicine en stond er garant voor dat zowel binnen een land als internationaal talloze behandelingen voor dezelfde aandoening bestonden waarvoor maar weinig wetenschappelijk bewijs bestond.
De vraag deed zich voor wat nu eigenlijk het beste bewijs is in de geneeskunde. Er bestonden tal van onderzoekstypen en voor veel artsen was (en is nog steeds) onduidelijk hoe ze de resultaten van die onderzoeken moesten interpreteren.
Onderzoeken kunnen worden onderscheiden in gerandomiseerde en observationele. In gerandomiseerd onderzoek worden meestal twee behandelingen met elkaar vergeleken waarbij het toeval bepaalt welke behandeling een patiënt krijgt. Het onderzoek wordt bij voorkeur dubbelblind uitgevoerd waarbij arts en patiënt niet weten wat de patiënt krijgt. Met deze onderzoeksvorm krijgt men de beste garantie dat de uitkomst vrijwel volledig door het medicijn wordt verklaard. In een meta-analyse worden meerdere gerandomiseerde onderzoeken samengevat en gekwantificeerd.
Bij observationeel onderzoek, zoals cohort- of patiëntcontrole-onderzoek, bepaalt niet het toeval maar een bepaalde omstandigheid welke behandeling een patiënt krijgt. Dit type onderzoek is vatbaar voor vele vormen van vertekening.
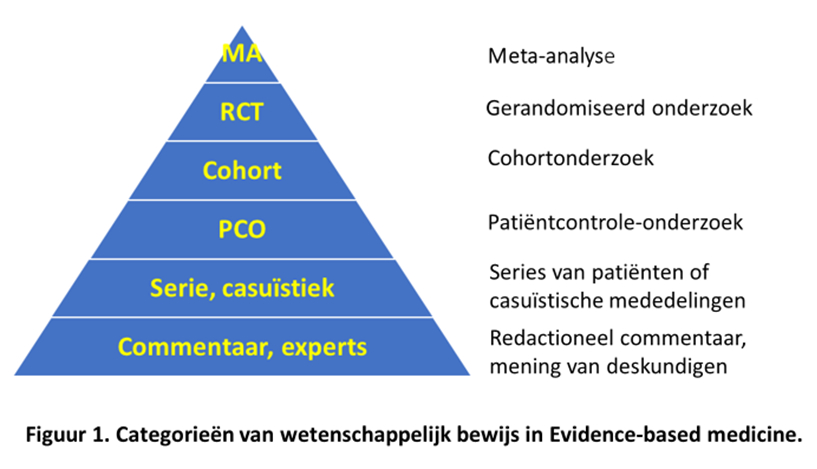
Categorieën van wetenschappelijk bewijs
De verschillende onderzoekstypen kunnen worden ingedeeld op basis van de sterkte van het wetenschappelijke bewijs. Een voorbeeld daarvan is weergegeven in de bovenstaande piramide. Op basis van de hierin genoemde categorieën worden in de wetenschappelijke literatuur en op congressen en symposia discussies gevoerd over de voor- en nadelen van behandelingen. Het gerandomiseerde en bij voorkeur dubbelblinde en al dan niet placebogecontroleerde onderzoek (RCT) is de gouden standaard van klinisch medicijnonderzoek.
Registratieautoriteiten stelden tot voor kort ook de eis aan fabrikanten dat ze voor het verkrijgen van een handelsvergunning de effecten van hun nieuwe medicijnen moesten aantonen met dit type onderzoek. Sinds enkele jaren zijn die eisen veel minder strikt geworden en komen nieuwe medicijnen veel makkelijker in de handel. Dit is bepaald niet altijd in het belang van patiënten.
De meta-analyse vormt de top van de piramide. Ofschoon RCT de gouden standaard is, betekent dit niet dat men blind kan varen op de uitkomsten. Deze uitkomsten moeten altijd kritisch worden beoordeeld, en daarom zijn discussies noodzakelijk om de wetenschap goed te kunnen duiden.
In de afgelopen 25 jaar heb ik mij in het bijzonder beziggehouden met de onderzoeksmethodologie en interpretatie van uitkomsten van medicijnonderzoek. Ik kwam daarbij steeds vaker tot de conclusie dat de meeste medicijnen niet werken en ook niet helpen. In Het pillenprobleem heb ik hierover verslag gedaan.[2]
Betere balans opmaken
De toepassing van EBM in onderzoek in de geneeskunde maakte meer en meer duidelijk wat men kon verwachten van behandelingen, en hoe goede van minder goede of slechte behandelingen konden worden onderscheiden. Sommige behandelingen brachten meer schade toe dan dat ze patiënten beter maakten en van veel andere behandelingen werd steeds duidelijker hoe weinig voordeel ze werkelijk opleverden.
Behandeleffecten konden worden uitgedrukt in bijvoorbeeld absolute risicoreducties en Number Needed to Treat (NNT). Dit duidt erop hoeveel patiënten men moet behandelen om bij een persoon een bepaalde aandoening, zoals een hartinfarct, te voorkomen. Als dat getal 4 of 5 is, is dat buitengewoon goed. Maar vaak waren die getallen torenhoog: 50, 100 of zelfs meer dan 500. Dergelijke getallen laten dus heel geringe effecten zien. Deze geringe effecten moeten vervolgens in relatie tot het Number Needed to Harm (NNH), dat is het aantal patiënten dat men moet behandelen om bij een persoon een bepaalde bijwerking te veroorzaken, worden geïnterpreteerd teneinde enigszins de balans van werkzaamheid en bijwerkingen op te kunnen maken.
Afsluiting
EBM is in handen van onafhankelijke onderzoekers een prachtig middel om goede en slechte wetenschappelijke onderzoeken van elkaar te onderscheiden. In een eerder bericht op overnu.nl is echter ook aangegeven dat EBM in sterke mate bedreigd wordt door artsen en onderzoekers met conflicterende belangen met de farmaceutische industrie. Dit is het bekende verschil tussen zakendoen en wetenschap bedrijven, en funest voor de wetenschappelijke geneeskunde.
1. Sackett DL, Scott Richardson W, Rosenberg W, Haynes RB. Evidence-based medicine. How to practice and Teach EBM. New York: Churchill Livingstone, 1997.
2. Bijl D. Het pillenprobleem. Amsterdam: AUP, 2018. Herziene uitgave 2020.







